Química del carbono
viernes, 15 de enero de 2016
viernes, 18 de diciembre de 2015
Etanol
El etanol es un compuesto químico obtenido a partir de la fermentación de los azúcares que puede utilizarse como combustible, solo, o bien mezclado en cantidades variadas con gasolina, y su uso se ha extendido principalmente para reemplazar el consumo de derivados del petróleo.
El combustible resultante de la mezcla de etanol y gasolina se conoce como gasohol o alconafta. Dos mezclas comunes son E10 y E85, con contenidos de etanol del 10% y 85%, respectivamente.
El etanol también se utiliza cada vez más como añadido para oxigenar la gasolina normal, reemplazando al éter metil tert-butílico (MTBE). Este último es responsable de una considerable contaminación del suelo y del agua subterránea. También puede utilizarse como combustible en las celdas de combustible.
Como fuente para la producción de etanol en el mundo se utiliza fundamentalmente biomasa. Este etanol es denominado, por su origen, bioetanol.
El etanol (Alcohol Etílico) puede producirse de dos formas. La mayor parte de la producción mundial se obtiene del procesamiento de materia de origen renovable (caña de azúcar y /o derivados como melaza; sorgo dulce; sorgo rojo; remolacha; etc); en particular, ciertas plantas con azúcares. El etanol así producido se conoce como bio-etanol. Por otra parte, también puede obtenerse etanol mediante la modificación química del etileno, por hidratación.
Bioetanol
El etanol es un combustible que puede producirse a partir de un gran número de plantas, con una variación, según el producto agrícola, del rendimiento entre el combustible consumido y el generado en dicho proceso. Este etanol, conocido como bioetanol, está sujeto a una fuerte polémica: para unos se perfila como un recurso energéticopotencialmente sostenible que puede ofrecer ventajas medioambientales y económicas a largo plazo en contraposición a los combustibles fósiles, mientras que para otros es el responsable de grandes deforestaciones y del aumento del precio de los alimentos, al suplantar selvas y terrenos agrícolas para su producción,1 dudando además de su rentabilidad energética.
El bioetanol tiene las mismas características y composición química que el etanol ya que se trata del mismo compuesto. La diferencia radica en su proceso de producción. El bioetanol ha de ser obtenido desde biomasa, no pudiendo obtenerse del petróleo.
Todos los licores alcohólicos que proceden de la fermentación del azúcar de alguna planta se pueden denominar como bioetanol
viernes, 27 de noviembre de 2015
La sacarosa se convierte en carbono puro
Una de las reacciones más espectaculares que se pueden llevar a cabo en un laboratorio, siempre que se disponga de todas las medidas de seguridad necesaria (en especial una campana extractora de gases) es la carbonización del azúcar de mesa con ácido sulfúrico, que es un ácido muy fuerte capaz de producir la deshidratación de la sacarosa para convertirla en carbono puro y duro, sólido y de estructura amorfa. La reacción, una vez mezclados ambos reactivos, es rápida y provoca una especie de géiser de carbón que se eleva y sale del vaso de precipitados, superando sus paredes.
Fuente: https://www.youtube.com/watch?v=4x7lRVpzYOk
viernes, 20 de noviembre de 2015
El benceno
Benceno. Líquido incoloro con olor dulce. Se evapora al aire rápidamente y es poco soluble en agua. Es altamente inflamable y se forma tanto de procesos naturales como de actividades humanas.
El benceno fue descubierto en 1825 por el científico inglés Michael Faraday, C6H6, como uno de los componentes de un aceite que recogió de las tuberías del gas del alumbrado. Su composición era C6H6, dada con símbolos modernos, y tenía un punto de fusión de 5 ° C y un punto de ebullición de 80 ° C.
Hoffmann, en 1845, lo encontró en el alquitrán de hulla, que es todavía la fuente principal del benceno y sus derivados. Se observó pronto que el benceno se comporta como el compuesto del que derivan un número enorme de compuestos, que habían sido aislados en la naturaleza o habían sido preparados en el laboratorio, con los famosos colorantes de alquitrán.
Una tonelada de carbón transformada en coque en un horno produce unos 7,6 litros de benceno. En la actualidad se obtienen del petróleo grandes cantidades de benceno, ya sea extrayéndolo directamente de ciertos tipos de petróleo en crudo o por tratamiento químico del mismo.
El benceno es usado extensamente en los Estados Unidos; ocupa el lugar número 20 en la lista de sustancias químicas de mayor volumen de producción. Algunas industrias usan benceno para manufacturar otras sustancias químicas usadas para fabricar plásticos, resinas, nylon y otras fibras sintéticas. El benceno también se usa para fabricar ciertos tipos de caucho, lubricantes, tinturas, detergentes, medicamentos y plaguicidas. Los volcanes y los incendios forestales son fuentes naturales de benceno. El benceno también es un componente natural del petróleo, la gasolina y el humo de cigarrillo.
Fuente: http://www.ecured.cu/index.php/Benceno
viernes, 13 de noviembre de 2015
La presencia de radicales en una cadena
| Fórmula | Nombre | Radical | Nombre |
| Metano | Metil-(o) | ||
| Etano | Etil-(o) | ||
| Propano | Propil-(o) | ||
| Butano | Butil-(o) | ||
| Pentano | Pentil-(o) | ||
| Hexano | Hexil-(o) | ||
| Heptano | Heptil-(o) | ||
| Octano | Octil-(o) |
Se llama radical alquilo a las agrupaciones de átomos procedentes de la eliminación de un átomo de H en un alcano, por lo que contiene un electrón de valencia disponible para formar un enlace covalente. Se nombran cambiando la terminación -ano por -ilo, o -il cuando forme parte de un hidrocarburo.
Cuando aparecen ramificaciones (cadenas laterales) hay que seguir una serie de normas para su correcta nomenclatura.
- Se elige la cadena más larga. Si hay dos o más cadenas con igual número de carbonos se escoge la que tenga mayor número de ramificaciones.
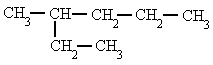 |
| 3-metilhexano |
- Se numeran los átomos de carbono de la cadena principal comenzando por el extremo que tenga más cerca alguna ramificación, buscando que la posible serie de números "localizadores" sea siempre la menor posible.
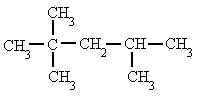 |
| 2,2,4-trimetilpentano, y no 2,4,4-trimetilpentano |
- Las cadenas laterales se nombran antes que la cadena principal, precedidas de su correspondiente número localizador y con la terminación "-il" para indicar que son radicales.
- Si un mismo átomo de carbono tiene dos radicales se pone el número localizador delante de cada radical y se ordenan por orden alfabético.
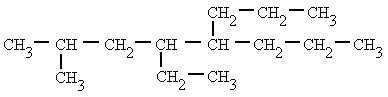 |
| 4-etil-2-metil-5-propiloctano |
- Si un mismo radical se repite en varios carbonos, se separan los números localizadores de cada radical por comas y se antepone al radical el prefijo "di-", "tri-", "tetra-", etc.
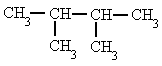 |
| 2,3-dimetilbutano Fuente: http://www.alonsoformula.com/organica/alcanos.htm |
sábado, 7 de noviembre de 2015
Hidrocarburos alquenos u olefinas
7/11/15
Propiedades de los alquenos
Propiedades de los alquenos
Propiedades físicas
Puntos de fusión y ebullición: aumentan con el peso molar de manera similar a los alcanos.
Densidad: son todos menos densos que el agua. La densidad se halla alrededor de 0,7 g/ml.
Solubilidad: son solubles en solventes no polares o poco polares como el benceno, éter o cloroformo-
Los isómeros geométricos tienen diferentes puntos de fusión, ebullición, densidad , solubilidad, etc, lo que se utiliza para identificarlos.
Reactividad:
La presencia del doble enlace los hace mucho más reactivos que los alcanos. Tienen reacciones de adición al doble enlace., siendo las más frecuentes la adición de hidrógeno o halógenos. Es muy importante a nivel industrial la polimerización de los alquenos.
USOS
La elevada reactividad del doble enlace los hace importantes intermediarios de la síntesis de una gran variedad de compuestos orgánicos.
Probablemente el alqueno de mayor uso industrial sea el ETILENO(eteno) que se utiliza entre otras cosas para obtener el plásticoPOLIETILENO, de gran uso en cañerías, envases, bolsas y aislantes eléctricos. También se utiliza para obtener alcohol etílico, etilen-glicol, cloruro de vinilo y estireno.
Fuente: http://quimicaparatodos.blogcindario.com/2009/08/00032
viernes, 23 de octubre de 2015
Propiedades químicas de los alcanos
Pirólisis: es la descomposición de una sustancia por la sola acción del calor. La pirólisis de alcanos, en particular en lo que concierne al petróleo, se conoce como cracking. En le cracking térmico, los alcanos se hacen pasar por una cámara calentada a temperatura elevada, con lo cual los alcanos de cadena larga y alta masa molar, se convierten en alcanos mas livianos, alquenos y algo de hidrógeno. la temperatura oscila entre 400°C y 600°C y la reacción se puede ejecutar con catalizador o sin él. La ecuación química general para la pirólisis es:

Fuente: www,youtube
Suscribirse a:
Entradas (Atom)
